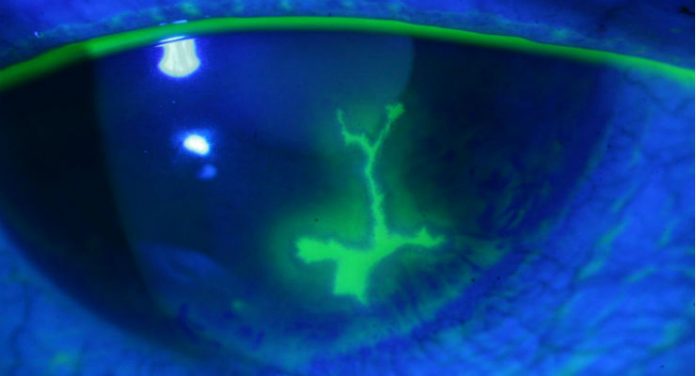
Gli herpesvirus sono parte di una grande famiglia di virus a Dna a doppio filamento che infettano animali ed esseri umani, caratteristici in quanto non lasciano l’organismo dopo averlo infettato, ma si annidano invece nelle cellule dell’ospite, causando un’infezione latente che si ripresenta a volte anche dopo molti anni e che può causare ricadute delle patologie associate. La maggior parte degli adulti ha nel proprio organismo in ogni momento un numero variabile di herpesvirus, in grado di causare herpes labiale, cheratite (come nella foto), herpes genitale, fuoco di Sant’Antonio, mononucleosi e altre malattie, tra cui alcuni tipi di cancro. Queste possono essere attivate da diversi sintomi, come ad esempio il caldo o il freddo, un trauma, febbre, stress o variazioni nella difesa immunitaria del nostro corpo.
Ma uno studio, pubblicato su Plos Pathogens, offre oggi qualche speranza in più nella lotta agli herpes. La ricerca infatti suggerisce che attaccare il Dna degli herpesvirus con la tecnologia di editing genetico CRISPR/Cas9 potrebbe portare alla soppressione della replicazione del virus e, in alcuni casi, alla sua eliminazione.
La tecnologia CRISPR/Cas9 prende infatti di mira specifiche sequenze del Dna modificandole in modo molto preciso. Nei mammiferi, questi tagli sono riparati da un sistema chiamato NHEJ (Non-Homologous End-Joining), efficiente ma non molto accurato, che a volta erroneamente inserisce o cancella alcune basi del Dna; questo può a volte causare un malfunzionamento del gene interessato e delle proteine a loro volta prodotte. Robert Jan Lebbink e il suo team dell’University Medical Center di Utrecht, hanno ipotizzato che CRISPR/Cas9 potesse essere utilizzato per prendere di mira e mutare il Dna degli herpesvirus presenti nel nostro corpo, in modo da prevenire complicazioni e malattie associate.
Per testare questa ipotesi, gli scienziati hanno creato specifiche sequenze chiamate gRNA che, combinate con il sistema CRISPR/Cas9, possono tagliare il Dna degli herpesvirus in modo da renderli innocui. In particolare, i ricercatori si sono concentrati su tre diversi membri della famiglia degli herpesvirus: HSV-1, che causa l’herpes labiale e la cheratite, HCMV o herpesvirus umano 5, la più frequente causa virale di difetti di nascita, e il virus di Epstein-Barr, che causa la mononucleosi e diversi tipi di cancro.
Lavorando su cellule di un linfoma infettato con il virus di Epstein-Barr, gli scienziati hanno mostrato che l’introduzione delle sequenze gRNA da loro create è in grado di provocare mutazioni che possono a loro volta destabilizzare il virus, facendo perdere fino al 95% del suo genoma nelle cellule ospite. Altri gRNA sono anche state in grado di danneggiare la replicazione dell’herpesvirus umano 5 e sopprimere completamente quella di HSV-1.
“Abbiamo osservato una pulizia altamente efficiente e specifica del virus di Epstein-Barr da cellule tumorali infette, e il danneggiamento della replicazione di HSV-1 e HCMV in cellule umane,” hanno concluso gli scienziati. Gli esperti sperano ora che i loro risultati aiuteranno a progettare strategie terapeutiche che prendano di mira gli herpesvirus umani durante le fasi latenti e produttive.
Riferimenti: PLOS Pathogens http://dx.doi.org/10.1371/journal.ppat.1005701