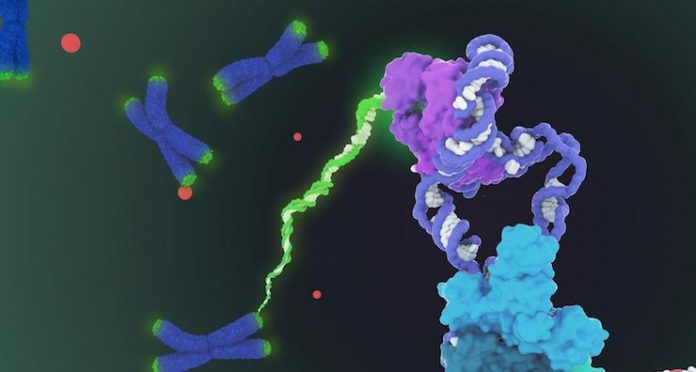
La sua è stata una scoperta da Nobel: nel 2009 infatti, il premio nel campo della Medicina venne assegnato a Elizabeth Blackburn, Carol Greider e Jack Szostak per aver individuato l’enzima telomerasi e aver ipotizzato la sua funzione all’interno della cellula. Oggi la ricerca si è spinta ancora più in là: i ricercatori guidati da Thi Hoang Duong Nguyen, del Dipartimento di Biologia molecolare e cellulare dell’Università della California a Berkeley, grazie alla microscopia crioelettronica, sono riusciti ad ottenere una fotografia ad altissima risoluzione della telomerasi, coinvolta nella protezione dell’integrità del DNA durante la duplicazione cellulare, il cui mal funzionamento può causare l’insorgenza di gravi patologie come alcuni tumori.

Conoscere i dettagli della sua struttura sarà molto importante anche in funzione terapeutica, giacché la funzione delle proteine è strettamente legata alla loro forma: la sua modificazione può dare origine a comportamenti anomali e dannosi, impedendo alla proteina di svolgere le funzione per cui è stata prodotta dall’organismo.
In questo studio, pubblicato su Nature, i ricercatori sono riusciti a fotografare la telomerasi con una risoluzione compresa tra gli 0,7 e gli 0,8 nanometri, addirittura tre volte più precisa dell’ultima rilevazione possibile. Grazie a questa precisione sono emersi nuovi dettagli di forma e funzioni delle diverse regioni della proteina, impossibili da cogliere prima: l’enzima è formato da due lobi distinti e uniti da RNA. Il primo di questi lobi posiziona correttamente l’enzima all’interno della cellula, mentre il secondo svolge la funzione enzimatica vera e propria: ripara i telomeri, porzioni di DNA che, posti ai margini dei cromosomi, non trasportano alcun tipo di informazione genetica ma vengono sistematicamente erosi ad ogni ciclo di duplicazione cellulare, proteggendo il resto del materiale genetico ed evitando la perdita di informazioni. Adesso, grazie alle informazioni sulla sua struttura, sappiamo che è probabilmente l’RNA a guidare l’enzima in questo processo di riparazione.
La ricerca e lo sviluppo di terapie efficaci legate alla telomerasi sono sempre stati limitati dalla poca conoscenza dei dettagli strutturali dell’enzima; che dalla sua scoperta, nel 1984, è stato subito associato all’insorgenza di diversi tipi di tumori, ma anche a fenomeni meno drammatici come l’invecchiamento.
Per arrivare a tanto, ricercatori si sono avvalsi della microscopia crioelettronica: un’evoluzione della microscopia elettronica che sfrutta l’azione di agenti refrigeranti per portare i campioni a bassissime temperature ed amplificare la risoluzione dei microscopi elettronici. Con questa tecnica si può lavorare anche con campioni di dimensioni limitate, un grandissimo vantaggio quando si deve studiare una molecola presente in concentrazioni molto basse nel nostro organismo, come per l’appunto la telomerasi. Con tecniche tradizionali, come per esempio la cristallografia a raggi X, sarebbe stato impossibile arrivare a risultati comparabili.
La ricerca rappresenta un primo passo verso immagini a risoluzioni ancora maggiori. Come nota Michel Stone dell’Università di Santa Cruz, in un commento su Nature, che pure definisce i risultati straordinari, bisognerà arrivare ad avere immagini a risoluzioni di 0,3-0,4 nanometri, per supportare lo sviluppo di nuove ed efficaci terapie.
Riferimenti: Nature
Articolo prodotto nell’ambito del Master in Giornalismo e comunicazione istituzionale della scienza dell’Università di Ferrara