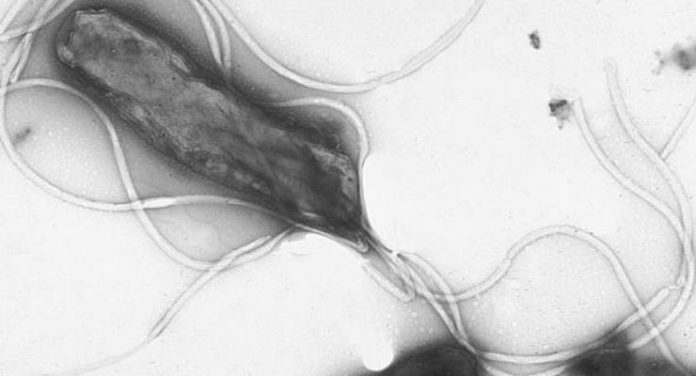
Se in passato avete avuto i sintomi della gastrite, come dolore o bruciore allo stomaco, probabilmente avrete sentito parlare di Helicobacter pylori. Questo batterio infetta circa la metà della popolazione mondiale, e ha il suo habitat nella mucosa gastrica dell’essere umano. Nella maggior parte dei casi, il batterio convive con il suo ospite e l’infezione è asintomatica. Tuttavia, in età adulta, può riattivarsi e danneggiare le pareti dello stomaco, causando gastriti e ulcere peptiche. Nei casi più gravi, le lesioni alla mucosa gastrica possono diventare maligne, tanto che due anni fa l’Agenzia Internazionale per la Ricerca sul Cancro (Iarc) ha raccomandato programmi di screening ed eradicazione di massa del batterio. L’attuazione di questi trattamenti, tuttavia, si scontra con il problema annoso della resistenza agli antibiotici, finora l’unica arma che abbiamo per debellare il patogeno.
Nel nostro gruppo di ricerca, ci siamo chiesti quale sia la strategia più promettente per ottenere nuovi farmaci contro H. pylori. A questo scopo, abbiamo studiato il modo peculiare con cui questo batterio colonizza il lume gastrico, un ambiente notoriamente inospitale, a causa delle condizioni di estrema acidità presenti. Per sopravvivere in questo sito, H. pylori ha bisogno di nichel, un elemento che conosciamo bene per la sua tossicità, ma che sappiamo anche coinvolto nella biochimica della vita. Ci siamo quindi chiesti come mai questo metallo, insolito e poco diffuso nel nostro organismo, sia essenziale per questo patogeno umano. La ragione sta nella capacità del batterio di inserire il nichel nell’ureasi, un enzima fondamentale per la sua sopravvivenza nell’ospite. L’attività dell’ureasi, infatti, aumenta il pH locale, creando una sorta di nuvola abitabile intorno alle cellule batteriche, in cui queste possono sopravvivere e riprodursi. Inibire l’attività di questo enzima significa quindi privare il patogeno dello scudo con cui si protegge dall’ambiente esterno e, di conseguenza, ucciderlo.
L’ureasi è così importante per H. pylori che questi ha imparato a regolare finemente la sua espressione e attività in risposta agli stimoli esterni, ad esempio accendendo e spegnendo il suo gene in risposta all’acidità dell’ambiente e alla quantità di nichel presente. Ci riesce grazie alla proteina ArsR, che funge da sentinella dell’acido, e che è a sua volta regolata da NikR e Fur, due proteine-sensori che “captano” nichel e ferro rispettivamente. Esiste quindi un’interconnessione tra le tre proteine – ArsR, NikR, e Fur – e quindi tra i tre stimoli che esse riconoscono – acido, nichel e ferro – che sottende alla regolazione dei fattori di virulenza del batterio e, in ultima analisi, alla sua decisione se proliferare.
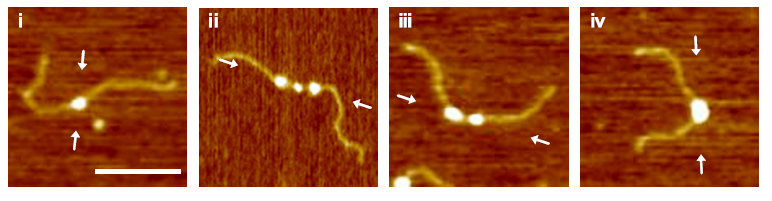
Come funziona questo meccanismo, a livello molecolare, è stato oggetto della nostra ricerca all’Università di Bologna i cui risultati sono stati recentemente pubblicati su Nature Communications. Utilizzando tecniche di biologia molecolare, abbiamo dimostrato che tra NikR e Fur c’è una competizione, che si esplica nel legame a una sequenza specifica di Dna, per regolare la sentinella dell’acido ArsR. Quale delle due proteine prevalga sull’altra dipende delle concentrazioni relative di nichel e ferro nell’ambiente cellulare: quando la concentrazione di ferro sale, Fur si aggrega sul Dna, spegnendo l’espressione di ArsR; se anche il nichel è presente, NikR compete per il legare il Dna, favorendo la produzione della sentinella dell’acido. Molto interessante è stato per me guardare direttamente il complesso tra il Dna e le proteine NikR e Fur, attraverso un tipo particolare di microscopio, chiamato microscopio a forza atomica (Afm), che riesce a distinguere le singole molecole di Dna e le proteine ad esso legato. Gli esperimenti di Afm, svolti in collaborazione con Claudio Rivetti dell’Università di Parma, dimostrano che il legame di Fur rende il Dna più compatto, formando una sorta di nodo, mostrato nell’immagine, in grado di spegnere l’espressione genica.
E ora cosa succede? “Andremo avanti con la ricerca, cercando di approfondire i meccanismi che hanno un ruolo nel modulare le vie metaboliche del batterio o nel regolare l’espressione altri fattori di virulenza, come accade per ArsR e l’ureasi”, racconta Alberto Danielli, il collega dell’Università di Bologna che ha guidato lo studio. “Lo scopo è trovare la strada per rendere il patogeno più vulnerabile e individuare possibili bersagli per nuove terapie di intervento.” Queste ultime sono sempre più urgenti, visto la crescente resistenza agli antibiotici che si manifesta per questo patogeno come per molti altri batteri.
Riferimenti: Nature Communications